Ο καρκίνος στομάχου (gastric cancer) είναι μια νεοπλασία που συχνά ξεκινά «σιωπηλά» και στα αρχικά στάδια μπορεί να θυμίζει απλή δυσπεψία. Παράγοντες κινδύνου είναι η μόλυνση με H. pylori, το κάπνισμα, η οικογενής προδιάθεση και ορισμένες διατροφικές συνήθειες. Η έγκαιρη γαστροσκόπηση με βιοψίες είναι το κλειδί για σίγουρη διάγνωση, ενώ η σταδιοποίηση με αξονικές, EUS και, όπου χρειάζεται, σταδιοποιητική λαπαροσκόπηση καθορίζει το πλάνο θεραπείας.
Η αντιμετώπιση εξατομικεύεται από διεπιστημονική ομάδα (MDT). Σε πολύ πρώιμους όγκους μπορεί να αρκεί ενδοσκοπική αφαίρεση (ESD). Στους περισσότερους χειρουργήσιμους ασθενείς εφαρμόζεται περιεγχειρητική χημειοθεραπεία (π.χ. FLOT) σε συνδυασμό με γαστρεκτομή και D2 λεμφαδενεκτομή, ιδανικά με ελάχιστα επεμβατικές τεχνικές και πρωτόκολλα ERAS για ταχύτερη ανάρρωση. Σε μεταστατική νόσο προτιμώνται συστηματικές θεραπείες (χημειο-, στοχευμένες, ανοσοθεραπεία) βάσει μοριακών δεικτών (HER2, PD-L1, MSI).
Στόχος μας είναι μια θεραπεία ασφαλής, αποτελεσματική και ανθρώπινη, με ισχυρή έμφαση στη θρέψη, στη διαχείριση συμπτωμάτων και στη συνεχή επικοινωνία με τον ασθενή.
Πότε θέλει άμεσα γαστροσκόπηση (red flags)
- Ακούσια απώλεια βάρους ή έντονη ανορεξία τις τελευταίες εβδομάδες/μήνες.
- Δυσφαγία (δυσκολία στην κατάποση) ή αίσθημα ότι «το φαγητό κολλάει».
- Επίμονος πόνος/κάψιμο στο επιγάστριο που επιδεινώνεται, δεν υποχωρεί με αγωγή ή επανεμφανίζεται γρήγορα.
- Αναιμία (ιδίως σιδηροπενική), ανεξήγητη κόπωση/ζάλη/λαχάνιασμα ή εργαστηριακή πτώση αιματοκρίτη.
- Αιμορραγία από το ανώτερο πεπτικό: μαύρα κόπρανα (μέλαινα) ή έμετος με αίμα.
- Επίμονοι έμετοι ή αίσθημα πρώιμου κορεσμού (χορταίνω πολύ γρήγορα) με προοδευτική επιδείνωση.
- Νέα συμπτώματα δυσπεψίας μετά τα 45–50 έτη ή συμπτώματα με ισχυρό οικογενειακό ιστορικό καρκίνου στομάχου.
(Αν υπάρχει αιμορραγία, έντονη αδυναμία/λιποθυμική τάση ή συνεχείς έμετοι → επείγουσα εκτίμηση.)
Γιά πληφορίες σχετικά με «Γαστρεκτομή (υφολική/ολική): τεχνικές & ανάρρωση» δείτε την αναλυτική σελίδα μας.
Επιδημιολογικά Δεδομένα
- Ο καρκίνος στομάχου(gastric cancer) αποτελεί ένα από τους πιο συχνούς καρκίνους παγκοσμίως
- Η υψηλότερη επίπτωση παρατηρείται στην Άπω Ανατολή (Ιαπωνία, Κορέα), Λατινική Αμερική (Χιλή, Κόστα Ρίκα) και Ανατολική Ευρώπη. Αντίθετα, στην Δυτική Ευρώπη, την Αυστραλία και τη Βόρειο Αμερική σημαντική μείωση τα τελευταία 30 χρόνια.
- Στη Δυτική Ευρώπη παρατηρούνται 25 περιστατικά καρκίνου στομάχου ανά 100.000 άνδρες και 14 περίπου περιστατικά ανά 100.000 γυναίκες. Η συχνότητα αυξάνει κατακόρυφα μετά την 6η δεκαετία της ζωής και φτάνει στις 200 περίπου περιπτώσεις ανά 100.000 άνδρες ηλικίας άνω των 80 ετών.
- Διεθνής τάση ελάττωσης της επίπτωσης του καρκίνου του στομάχου τα τελευταία 30 χρόνια και παρατηρείται επίσης μια τάση «μετακίνησης» της εντόπισης του καρκίνου από το άντρον στη γαστροοισοφαγική συμβολή.
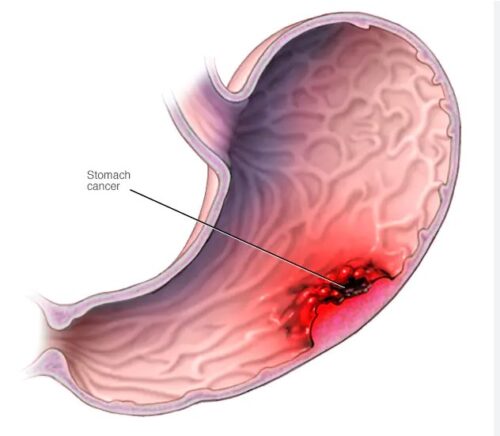
Καρκίνος Στομάχου (gastric cancer) – Αιτιολογία
- Οι διατροφικές συνθήκες και η λοίμωξη με ελικοβακτηρίδιο του πυλωρού (H. Pylori) είναι οι δύο πιο σημαντικοί περιβαλλοντολογικοί παράγοντες, που ενοχοποιούνται για την ανάπτυξη του καρκίνου του στομάχου.
- Σε μικρό αριθμό περιπτώσεων υπάρχουν ενδείξεις για οικογενή γενετική προδιάθεση.
- Ισχυρή συσχέτιση μεταξύ καπνίσματος και καρκίνου του οισοφάγου και του θόλου του στομάχου.
- Χαμηλότερη επίπτωση σε ανθρώπους, που καταναλώνουν πολλά φρούτα και λαχανικά. Η βιταμίνη C που περιέχεται σε αρκετά φρούτα και η β-καροτίνη που ανευρίσκεται σε πολλά λαχανικά είναι αντιοξειδωτικές ουσίες και πιστεύεται ότι προστατεύουν έναντι της νόσου.
- Στους διατροφικούς παράγοντες κινδύνου καρκίνου στο στομάχι, περιλαμβάνεται η επί μακρόν και συχνή κατανάλωση αλλαντικών, παστών ψαριών, τουρσιών κτλ
- Οι προαναφερθέντες διατροφικοί παράγοντες, καθώς επίσης και η λοίμωξη με H. Pylori προδιαθέτουν σε χρόνια γαστρίτιδα, τελικό αποτέλεσμα της οποίας είναι η ατροφική γαστρίτιδα.
- Πρώιμη εμφάνιση ατροφικής γαστρίτιδας είναι συχνή σε πολλούς ασθενείς που αναπτύσσουν καρκίνο του στομάχου. Καταστάσεις που χαρακτηρίζονται από ατροφική γαστρίτιδα και αχλωρυδρία (κακοήθης αναιμία, υπογαμμασφαιριναιμία, μερική γαστρεκτομή) αποτελούν παράγοντες κινδύνου για την ανάπτυξη καρκίνου του στομάχου.
- Όταν ενοχοποιείται η λοίμωξη με Η. Pylori κυρίαρχη «διαδικασία» είναι η εμφάνιση εντερικής μεταπλασίας à δυσπλασίας à ανάπτυξη «εντερικού» τύπου καρκίνου. Αυτός ο τύπος καρκίνου του στομάχου είναι πιο συχνός στους ηλικιωμένους και επίσης στις περιοχές του κόσμου με υψηλή επίπτωση καρκίνου του στομάχου. Αντίθετα ο «διάχυτος» τύπος καρκίνου του στομάχου είναι πιο συχνός σε νεώτερους ασθενείς και με σταθερή επίπτωση παγκοσμίως. Ο «εντερικός» τύπος γαστρικού καρκίνου έχει καλύτερη πρόγνωση από τον διάχυτο τύπο.
- Καλύτερη διατροφή, καλύτερες συνθήκες διαβίωσης και δημόσιας υγείας συνέβαλαν αποφασιστικά στην ελάττωση του καρκίνου του στομάχου στις ανεπτυγμένες χώρες.
Παθολογική Ανατομική
- Ο καρκίνος στομάχου (gastric cancer), διακρίνεται κατ’ αρχήν σε «πρώιμο» και σε «προχωρημένο». Ο πρώιμος γαστρικός καρκίνος (early gastric cancer) περιορίζεται στον βλεννογόνο ή και τον υποβλεννογόνο ανεξάρτητα από την διήθηση ή όχι λεμφαδένων. 40% των νέων περιπτώσεων καρκίνου στομάχου στην Ιαπωνία ανήκουν στον πρώιμο γαστρικό καρκίνο, ενώ το αντίστοιχο ποσοστό στις Δυτικές χώρες είναι μόλις 10%. Ο προχωρημένος γαστρικός καρκίνος (advanced gastric cancer) διηθεί την μυϊκή στοιβάδα και πέραν του στομάχου. Μορφολογικά ταξινομείται σε προέχοντα, επίπεδο και ελκωτικό τύπο.
- Ο πρώιμος γαστρικός καρκίνος συνήθως είναι ελκωτικός με μέση διάμετρο 1,5 – 3 cm. Στο 5-10% των περιπτώσεων παρατηρούνται και άλλοι σύγχρονοι όγκοι, ενώ στο 20% περίπου των ασθενών παρατηρείται και διήθηση λεμφαδένων. Η φυσική ιστορία του πρώιμου γαστρικού καρκίνου είναι: εξέλκωση του βλεννογόνου à επούλωση à νέα εξέλκωση. Εμφανίζεται με άτυπα συμπτώματα, κυρίως «δυσπεψία»που υποχωρεί με τα φάρμακα που ελαττώνουν την γαστρική οξύτητα και επουλώνουν το «έλκος» με συνέπεια να καθυστερεί η ενδοσκοπική διάγνωση του καρκίνου. Η μέση χρονική περίοδος για την μετάπτωση του πρώιμου γαστρικού καρκίνου σε προχωρημένο είναι 36 μήνες.
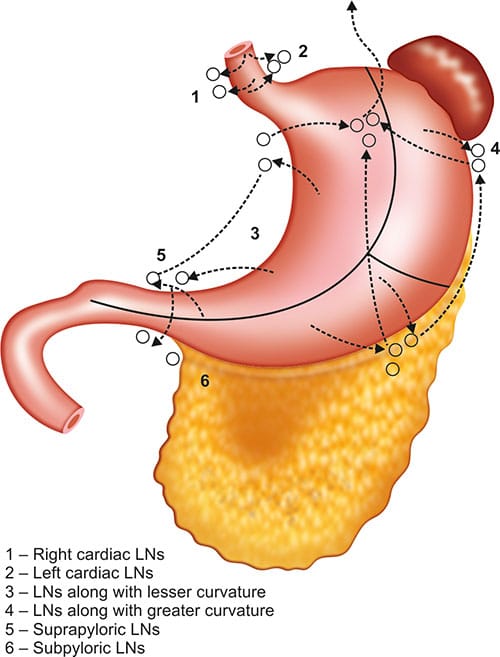
- Ο καρκίνος του στομάχου επεκτείνεται κατά συνέχεια ιστού, λεμφογενώς, αιματογενώς (ήπαρ, πνεύμονες, οστά) και με ενδοπεριτοναϊκές εμφυτεύσεις (ωοθήκες, όγκοι του Kru – Kenberg, δουγλάσσειος – όγκος του Blummer).
Κλινική Εικόνα
Άτυπα συμπτώματα καθυστερούν τη διάγνωση του καρκίνου στο στομάχι: δυσπεψία, ανορεξία, πρώιμο αίσθημα κορεσμού, απώλεια βάρους.
Η συμπτωματολογία του καρκίνου στομάχου ποικίλλει ανάλογα με τη θέση του όγκου (άντρο, σώμα, πυλωρός, γαστροοισοφαγική συμβολή) και το στάδιο. Στα αρχικά στάδια τα συμπτώματα μπορεί να είναι ήπια ή και απόντα.
Πρώιμα/μη ειδικά συμπτώματα
- Δυσπεψία/καύσος που επιμένει ή νέα δυσπεψία μετά τα 45–50 έτη
- Αίσθημα βάρους ή πρώιμος κορεσμός (χορταίνω γρήγορα)
- Ήπιος επιγαστραλγικός πόνος ή ενόχληση, συχνά μετά το φαγητό
- Φούσκωμα, ναυτία, περιστασιακοί έμετοι
- Ανεξήγητη κόπωση ή μείωση αντοχής
Συμπτώματα συναγερμού (red flags)
- Ακούσια απώλεια βάρους
- Αιμορραγία πεπτικού: μέλαινες κενώσεις ή εμέτοι με αίμα
- Σιδηροπενική αναιμία (ωχρότητα, ζάλη, δύσπνοια στην κόπωση)
- Δυσφαγία (δυσκολία στην κατάποση), ιδίως σε όγκους στη γαστροοισοφαγική συμβολή
- Επίμονος έμετος ή γαστρική απόφραξη (πυλωρική)
Αν υπάρχει έστω και ένα από τα παραπάνω, συνιστάται άμεση γαστροσκόπηση.
Ειδικά κλινικά σενάρια ανά εντόπιση
- Άντρο/πυλωρός: μεταγευματικός πόνος, ναυτία, εμέτοι (υποψία υποπύλωρης απόφραξης).
- Σώμα στομάχου: συχνά σιωπηρή πορεία με αναιμία και καταβολή.
- Γαστροοισοφαγική συμβολή (EGJ): καούρες/ΓΟΠΝ, δυσφαγία, οπισθοστερνικός πόνος.
Φυσική εξέταση & ευρήματα
- Συχνά φυσιολογική στα πρώιμα στάδια.
- Ωχρότητα (αναιμία), ευαισθησία επιγαστρίου.
- Σπάνια: διογκωμένοι λεμφαδένες (π.χ. Virchow), κοιλιακή μάζα, ασκίτης.
Εργαστηριακά/υποστηρικτικά ευρήματα (ενδεικτικά)
- Μικροκυτταρική σιδηροπενική αναιμία, χαμηλή φεριτίνη
- Ήπια υπολευκωματιναιμία (σε προχωρημένη νόσο/κακή θρέψη)
- Οι καρκινικοί δείκτες (π.χ. CEA, CA 19-9) δεν διαγιγνώσκουν, αλλά μπορεί να χρησιμοποιηθούν για παρακολούθηση σε επιλεγμένες περιπτώσεις.
Διαφορική διάγνωση (τι «μιμείται»)
- Λοίμωξη/γαστρίτιδα από H. pylori, λειτουργική δυσπεψία
- Πεπτικό έλκος, φαρμακο-σχετιζόμενη γαστρίτιδα (ΜΣΑΦ)
- Παλινδρόμηση/οισοφαγίτιδα, διαφραγματοκήλη
- Παθήσεις χοληφόρων/παγκρέατος με επιγαστραλγία
Πότε να απευθυνθεί ο ασθενής
- Επίμονη δυσπεψία >4–6 εβδομάδες παρά την αγωγή
- Οποιοδήποτε σύμπτωμα συναγερμού ή οικογενειακό ιστορικό γαστρικού καρκίνου/κληρονομικών συνδρόμων
- Ανεξήγητη αναιμία ή απώλεια βάρους
Καρκίνος Στομάχου – Διάγνωση – Σταδιοποίηση
Στόχος της διάγνωσης είναι να επιβεβαιώσουμε ότι πρόκειται για καρκίνο, να δούμε πόσο έχει επεκταθεί (στάδιο) και να αποφασίσουμε το σωστό πλάνο (π.χ. χημειοθεραπεία πριν το χειρουργείο, είδος επέμβασης κ.λπ.).
1) Βασικές εξετάσεις
- Γαστροσκόπηση με βιοψίες: επιβεβαιώνει τη διάγνωση και τον τύπο του όγκου.
- Αξονικές τομογραφίες (CT) θώρακα–κοιλιάς–πυέλου: ελέγχουν αν υπάρχει επέκταση σε λεμφαδένες ή άλλα όργανα.
- Ενδοσκοπικός υπέρηχος (EUS): ειδική εξέταση που δείχνει πόσο βαθιά έχει «μπει» ο όγκος στο τοίχωμα του στομάχου και αν έχουν πειραχτεί κοντινοί λεμφαδένες.
- PET/CT (επιλεκτικά): βοηθά να εντοπιστούν «κρυφές» εστίες όταν υπάρχει υποψία που δεν φαίνεται ξεκάθαρα στην CT.
- Σταδιοποιητική λαπαροσκόπηση (όπου χρειάζεται): με 2–3 μικροσκοπικές οπές στην κοιλιά, ο χειρουργός «ρίχνει μια ματιά» στο περιτόναιο και παίρνει υγρά/δειγματοληψίες για να αποκλείσει μικροσκοπική διασπορά που δεν φαίνεται στις τομογραφίες.
- Εξετάσεις αίματος & θρέψης: γενική αίματος (π.χ. για αναιμία), δείκτες θρέψης (λευκωματίνη), έλεγχος νεφρικής/ηπατικής λειτουργίας. Είναι σημαντικά για να σχεδιαστεί σωστά η θεραπεία και να προετοιμαστεί ο οργανισμός.
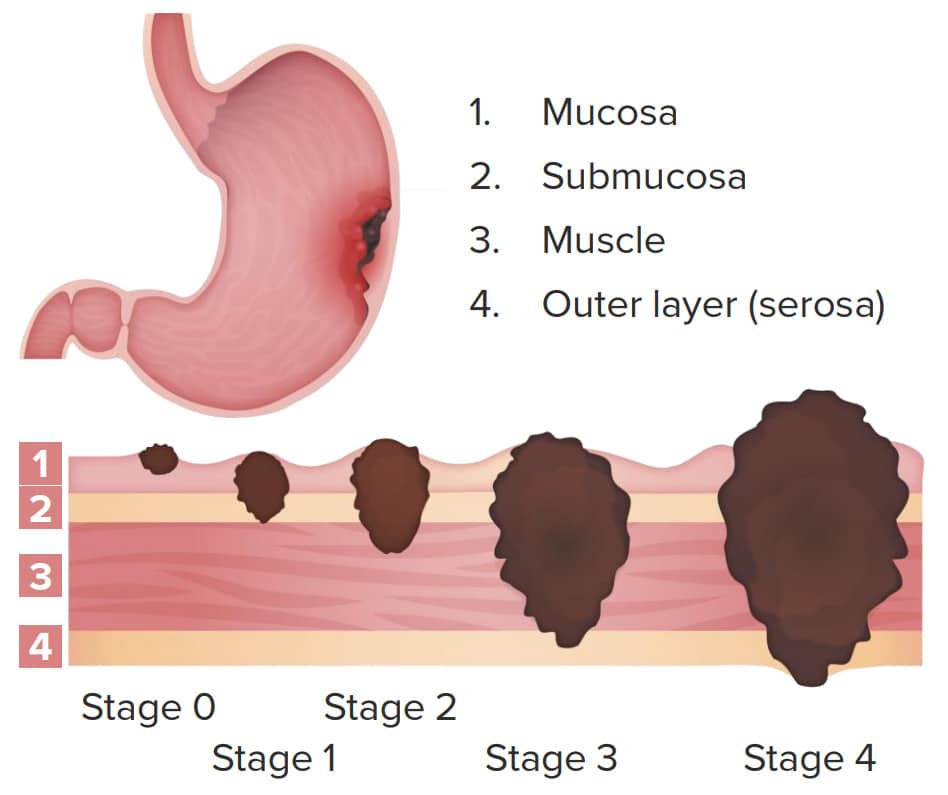
2) Τι σημαίνει «σταδιοποίηση» (σύστημα TNM)
- T (Tumor): πόσο βαθιά έχει προχωρήσει ο όγκος στο τοίχωμα του στομάχου.
- N (Nodes): αν έχουν προσβληθεί κοντινοί λεμφαδένες.
- M (Metastasis): αν υπάρχει μετάσταση σε άλλα όργανα (ή στο περιτόναιο).
Με βάση τα παραπάνω, προκύπτουν τα στάδια I–IV:
- Στάδιο I: νωρίς, συνήθως επιφανειακός όγκος και λίγοι/κανένας λεμφαδένας.
- Στάδιο II: βαθύτερη διήθηση ή/και περισσότεροι τοπικοί λεμφαδένες.
- Στάδιο III: προχωρημένη τοπικά νόσος με αρκετούς λεμφαδένες, αλλά χωρίς μακρινές μεταστάσεις.
- Στάδιο IV: υπάρχουν μακρινές μεταστάσεις (π.χ. ήπαρ, πνεύμονας) ή περιτοναϊκή διασπορά.
Η σωστή σταδιοποίηση είναι κρίσιμη, γιατί καθορίζει αν ξεκινάμε με χημειοθεραπεία , πότε γίνεται το χειρουργείο και ποια μορφή επέμβασης χρειάζεται.
3) Τι ισχύει για τους όγκους στη γαστροοισοφαγική συμβολή (EGJ)
Σε όγκους κοντά στη συμβολή οισοφάγου–στομάχου, χρησιμοποιούμε και την ταξινόμηση Siewert (I–III) για να αποφασιστεί αν η επέμβαση θα είναι πιο «οισοφαγική» ή «γαστρική» και ποια προεγχειρητική θεραπεία ταιριάζει καλύτερα.
4) Απλός «οδικός χάρτης» βημάτων
- Γαστροσκόπηση + βιοψίες → επιβεβαίωση διάγνωσης.
- CT θώρακα–κοιλιάς–πυέλου (± EUS, ± PET/CT αν χρειάζεται).
- Σταδιοποιητική λαπαροσκόπηση σε ύποπτα/προχωρημένα περιστατικά για να αποκλειστεί «κρυφή» περιτοναϊκή νόσος.
- Συνολική εκτίμηση TNM → απόφαση σε Διεπιστημονικό Συμβούλιο (MDT):
- Πρώιμη, πολύ επιφανειακή νόσος: σε επιλεγμένες περιπτώσεις μπορεί να συζητηθεί ενδοσκοπική αφαίρεση (ESD).
- Χειρουργήσιμη, προχωρημένη τοπικά νόσος (χωρίς μεταστάσεις): συνήθως χημειοθεραπεία πριν και μετά (π.χ. FLOT) + γαστρεκτομή με D2 λεμφαδενεκτομή.
- Μεταστατική νόσος: συστηματικές θεραπείες (χημειο/στοχευμένες/ανοσοθεραπεία), με στόχο τον έλεγχο της νόσου και την ποιότητα ζωής.
Τι να κρατήσετε
- Η γαστροσκόπηση με βιοψίες δίνει τη διάγνωση.
- Οι τομογραφίες, το EUS και ενίοτε η λαπαροσκόπηση μάς δείχνουν το στάδιο.
- Το στάδιο (I–IV) είναι ο «οδηγός» για το πλάνο θεραπείας σας.
- Όλα αποφασίζονται συντονισμένα από εξειδικευμένη ομάδα (MDT), για τη μέγιστη ασφάλεια και αποτελεσματικότητα.
Καρκίνος Στομάχου (gastric cancer) & Αντιμετώπιση
Ποιος σχεδιάζει τη θεραπεία;
Η πορεία αποφασίζεται σε Διεπιστημονικό Συμβούλιο (MDT) με γαστρεντερολόγο, χειρουργό, ογκολόγο, ακτινοθεραπευτή, παθολογοανατόμο, ακτινολόγο και διαιτολόγο. Στόχος: μέγιστη αποτελεσματικότητα με ελάχιστη επιβάρυνση.
1) Όταν ο καρκίνος είναι πολύ πρώιμος (επιφανειακός)
- ESD (ενδοσκοπική υποβλεννογόνια εκτομή): αφαιρεί τον όγκο από μέσα, χωρίς μεγάλη τομή, μόνο όταν πληρούνται αυστηρά κριτήρια (βάθος, μέγεθος, ιστολογικά χαρακτηριστικά).
- Παρακολούθηση: τακτικές γαστροσκοπήσεις και απεικονιστικός έλεγχος σύμφωνα με το πλάνο του γιατρού.
2) Όταν ο καρκίνος είναι χειρουργήσιμος αλλά πιο προχωρημένος τοπικά (χωρίς μεταστάσεις)
- Περιεγχειρητική χημειοθεραπεία :
- Πριν το χειρουργείο: ~4 κύκλοι για να μικρύνει ο όγκος και να αυξηθεί η πιθανότητα «καθαρής» αφαίρεσης.
- Μετά το χειρουργείο: ~4 κύκλοι για να μειωθεί ο κίνδυνος υποτροπής.
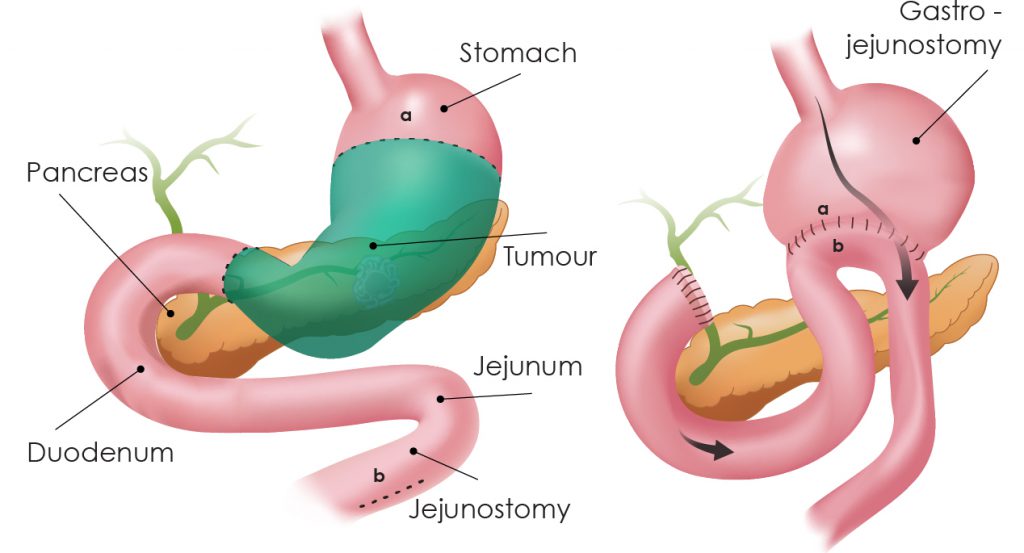
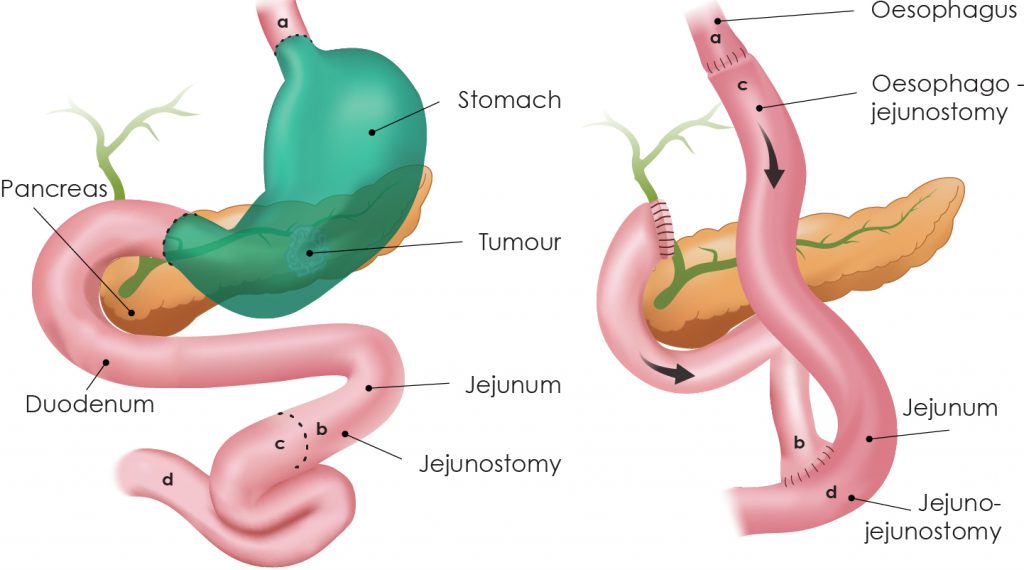
- Χειρουργείο (γαστρεκτομή) με D2 λεμφαδενεκτομή:
- Υφολική (αφαιρείται το κάτω/μεσαίο τμήμα) ή ολική (όλο το στομάχι), ανάλογα με τη θέση/έκταση.
- Γίνεται, όπου ενδείκνυται, ελάχιστα επεμβατικά (λαπαροσκοπικά/ρομποτικά) για λιγότερο πόνο και ταχύτερη ανάρρωση, χωρίς συμβιβασμό στην ογκολογική ασφάλεια.
- Ανακατασκευή: συνήθως Roux-en-Y για ασφαλή δίοδο τροφής.
- ERAS πρωτόκολλα: στοχεύουν σε γρηγορότερη ανάρρωση (έγκαιρη κινητοποίηση, καλή αναλγησία, πρώιμη σίτιση όταν επιτρέπεται).
3) Όταν υπάρχουν μεταστάσεις (στάδιο IV)
- Συστηματικές θεραπείες με στόχο τον έλεγχο της νόσου και τη διατήρηση ποιότητας ζωής:
- Χημειοθεραπεία (συνδυασμοί που επιλέγονται σύμφωνα με την κατάστασή σας).
- Στοχευμένες θεραπείες (π.χ. αν ο όγκος έχει HER2).
- Ανοσοθεραπεία σε κατάλληλους ασθενείς .
- Χειρουργείο ή ακτινοθεραπεία μπορεί να χρησιμοποιηθούν παρηγορικά (π.χ. για απόφραξη ή αιμορραγία), αν χρειαστεί.
4) Ειδικές περιπτώσεις που επηρεάζουν την επιλογή
- Μοριακά χαρακτηριστικά όγκου:
- HER2+, PD-L1, MSI-H/dMMR κ.ά. κατευθύνουν σε στοχευμένη ή ανοσοθεραπεία.
- Γαστροοισοφαγική συμβολή (EGJ): ειδικός σχεδιασμός (ταξινόμηση Siewert) για το είδος επέμβασης ή/και την προεγχειρητική θεραπεία.
- Θρέψη & φυσική κατάσταση: η διατροφική υποστήριξη πριν/μετά τη θεραπεία μειώνει επιπλοκές και βοηθά να ολοκληρωθούν οι κύκλοι χημειοθεραπείας στην ώρα τους.
5) Τι να περιμένετε πρακτικά (χρονοδιάγραμμα)
- Ολοκλήρωση σταδιοποίησης (γαστροσκόπηση/βιοψίες, αξονικές, ± EUS, ± λαπαροσκόπηση).
- Έναρξη θεραπείας σύμφωνα με το στάδιο (π.χ. FLOT → χειρουργείο → FLOT).
- Χειρουργείο (υφολική/ολική γαστρεκτομή + D2).
- Αποκατάσταση με ERAS και επάνοδος στις δραστηριότητες προοδευτικά.
- Συνέχιση/ολοκλήρωση θεραπείας (αν προβλέπεται) και πρόγραμμα παρακολούθησης.
6) Συχνές παρενέργειες και διαχείριση
- Χημειοθεραπεία: κόπωση, ναυτία, μούδιασμα στα άκρα· αντιμετωπίζονται με υποστηρικτικά φάρμακα/προσαρμογές δόσεων.
- Μετά το χειρουργείο: αλλαγές στη σίτιση (μικρά, συχνά γεύματα), πιθανό dumping, ανάγκη για βιταμίνη B12 (ιδίως μετά από ολική), προσοχή σε σίδηρο/ασβέστιο/βιταμίνη D.
- Ψυχολογική υποστήριξη: είναι μέρος της θεραπείας—ζητήστε βοήθεια όταν τη χρειάζεστε.
7) Παρακολούθηση (follow-up)
- Τακτικές επισκέψεις με κλινική εξέταση, εργαστηριακά και απεικονιστικό έλεγχο όπως θα οριστεί από την ομάδα.
- Έμφαση σε διατροφή, σωματικό βάρος, συμπτώματα όπως δυσφαγία, εμετοί, πόνος, αναιμία.
Πρόγνωση Καρκίνου Στομάχου
Η πρόγνωση στον καρκίνο του στομάχου καθορίζεται κυρίως από το στάδιο (TNM): πόσο βαθιά διηθεί ο όγκος το τοίχωμα, αν υπάρχουν λεμφαδενικές μεταστάσεις και αν υπάρχει απομακρυσμένη νόσος. Εξίσου σημαντικά είναι η βιολογία/ιστολογία (π.χ. εντερικού ή διάχυτου τύπου), ο βαθμός διαφοροποίησης, η γενική κατάσταση του ασθενούς και η δυνατότητα για ριζική χειρουργική εκτομή (R0) όταν αυτό είναι εφικτό. Σήμερα, οι μοριακοί δείκτες (όπως HER2 και άλλοι) επηρεάζουν τις διαθέσιμες συστηματικές θεραπείες και, έμμεσα, την πρόγνωση, γι’ αυτό η αντιμετώπιση οργανώνεται ιδανικά από διεπιστημονική ομάδα (MDT).
Επιβίωση Καρκίνου Στομάχου
Οι δείκτες επιβίωσης εξαρτώνται έντονα από το στάδιο στη διάγνωση. Σε δεδομένα πληθυσμού (SEER/ΗΠΑ), η 5ετής σχετική επιβίωση είναι περίπου 36% συνολικά, αλλά είναι περίπου 75–76% όταν η νόσος είναι εντοπισμένη, ~36–37% όταν είναι περιοχική (λεμφαδένες) και ~7–8% όταν είναι απομακρυσμένη/μεταστατική. Αυτοί οι αριθμοί είναι στατιστικοί μέσοι όροι (δεν προβλέπουν το τι θα γίνει σε ένα συγκεκριμένο άτομο) και επηρεάζονται από πολλούς παράγοντες, όπως τα χαρακτηριστικά του όγκου, η ανταπόκριση στη θεραπεία και το πόσο νωρίς γίνεται η διάγνωση.
FAQ – Συχνές Ερωτήσεις
- Ποια είναι τα συχνότερα συμπτώματα του καρκίνου στομάχου και πότε να ζητήσω εκτίμηση;
- Επίμονη δυσπεψία/καούρες, αίσθημα πρώιμου κορεσμού, ανεξήγητη απώλεια βάρους, ναυτία/έμετοι, πόνος ή «βάρος» στο άνω μέρος της κοιλιάς, αναιμία ή μαύρα κόπρανα. Αν τα συμπτώματα κρατούν >2–3 εβδομάδες, αν έχετε δυσκολία στην κατάποση ή χάσατε βάρος χωρίς λόγο, ζητήστε άμεσα ιατρική εκτίμηση.
- Πώς γίνεται η διάγνωση και η σταδιοποίηση;
- Η βασική εξέταση είναι η γαστροσκόπηση με βιοψίες. Για τη σταδιοποίηση χρησιμοποιούνται αξονική/μαγνητική τομογραφία, ενδοσκοπικό υπερηχογράφημα (σε επιλεγμένες περιπτώσεις) και αιματολογικοί/μοριακοί δείκτες (π.χ. HER2, MSI/dMMR, PD-L1) που βοηθούν στην επιλογή θεραπείας.
- Πότε χρειάζεται χειρουργείο και ποια τεχνική προτιμάται;
- Σε εντοπισμένη νόσο, η θεραπεία εκλογής είναι η γαστρεκτομή (μερική ή ολική) με ογκολογική λεμφαδενεκτομή (D2), κατά προτίμηση με ελάχιστα επεμβατική προσέγγιση (λαπαροσκοπική ή ρομποτική), όταν υπάρχουν οι ενδείξεις και η εμπειρία. Σε στάδια που το επιβάλλουν, προηγείται ή/και ακολουθεί χημειοθεραπεία (π.χ. σχήμα FLOT) βάσει ογκολογικού συμβουλίου.
- Μπορεί να αντιμετωπιστεί χωρίς μεγάλο χειρουργείο; Τι είναι ESD/EMR;
- Σε πολύ αρχόμενους, επιφανειακούς καρκίνους (early gastric cancer) με αυστηρά κριτήρια, η αφαίρεση του όγκου μπορεί να γίνει ενδοσκοπικά (ESD/EMR), χωρίς κοιλιακές τομές. Η επιλογή απαιτεί ακριβή σταδιοποίηση, αξιολόγηση κινδύνου λεμφαδενικών μεταστάσεων και εμπειρία εξειδικευμένης ομάδας.
- Τι να περιμένω μετά τη γαστρεκτομή; (ανάρρωση & διατροφή)
- Συνήθως νοσηλεία 3–7 ημέρες με πρωτόκολλο ERAS (γρήγορη κινητοποίηση, έγκαιρη σίτιση). Η επιστροφή στις καθημερινές δραστηριότητες γίνεται σταδιακά σε 2–4 εβδομάδες· η διατροφή προσαρμόζεται σε μικρά, συχνά γεύματα με καθοδήγηση διαιτολόγου. Θα λάβετε εξατομικευμένες οδηγίες για συμπληρώματα/βιταμίνες όπου χρειάζεται.
Τελευταία ιατρική επιμέλεια: 29/01/2026 από τον Δρ. Γεώργιος Σάμπαλης, MD, PhD

