Ο καρκίνος του ορθού (rectal cancer) και του παχέος εντέρου είναι ο τρίτος πιο συχνός τύπος καρκίνου που διαγιγνώσκεται στο δυτικό κόσμο. Κάθε χρόνο παγκοσμίως, περισσότεροι από 1.200.000 άνθρωποι θα διαγνωσθούν με καρκίνο του παχέος εντέρου και ορθού, ενώ, δυστυχώς, μέσα στο ίδιο έτος παγκοσμίως θα χάσουν τη ζωή τους περισσότεροι από 600.000 άνθρωποι από τον ίδιο καρκίνο.
Το ορθό αποτελεί το τελικό μέρος του παχέος εντέρου πριν τον πρωκτό. Είναι ένας μυικός σωλήνας που βρίσκεται στο πυελικό μέρος της κοιλιάς, εκτός του ενδοκοιλιακού (ενδοπεριτοναϊκού χώρου), και έχει δύο σημαντικά χαρακτηριστικά που το κάνει να διαφέρει από το υπόλοιπο παχύ έντερο (κόλον).
- Το τμήμα αυτό του εντέρου δεν περιβάλλεται από ορογόνο χιτώνα όπως το υπόλοιπο παχύ έντερο, δηλαδή έχει ένα χιτώνα λιγότερο, γεγονός που το κάνει πιο ευάλωτο στην ανάπτυξη – επέκταση όγκου προς τα έξω.
- Το κατώτερο τμήμα αυτού καταλήγει στον σφιγκτηριακό μηχανισμό του πρωκτού, δηλαδή στους μυς εκείνους που ορίζουν την εγκράτεια στο περιεχόμενο του εντέρου.
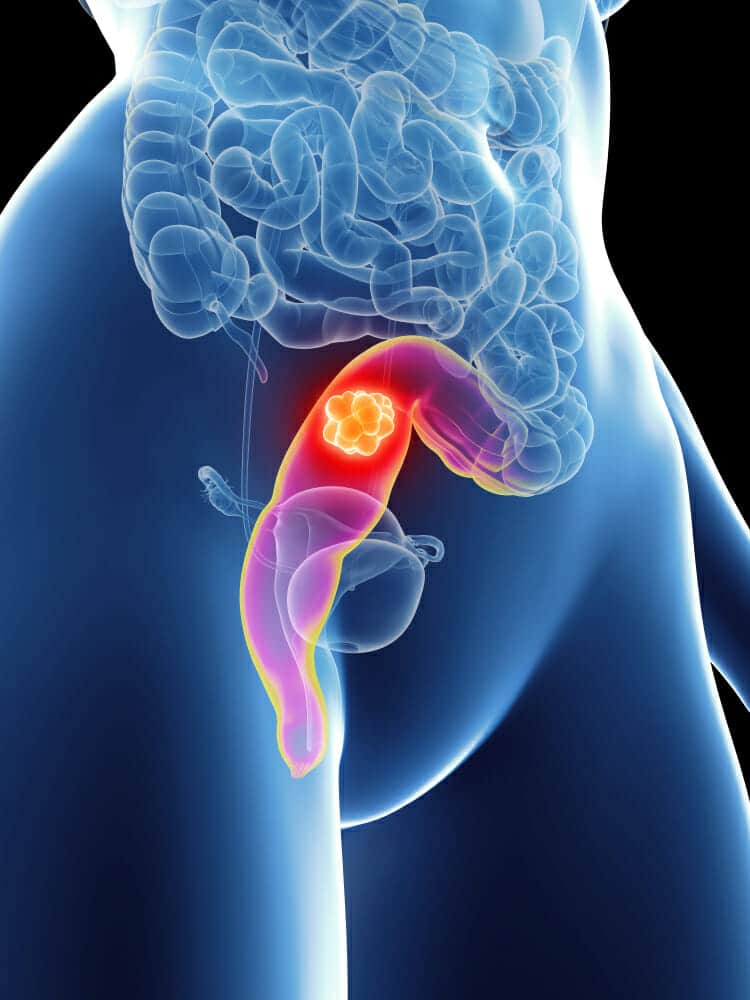
Αίτια καρκίνου του ορθού (rectal cancer)
Στους περισσότερους ασθενείς, τα αίτια ανάπτυξης του καρκίνου του παχέος εντέρου και του ορθού παραμένουν άγνωστα.
Γνωρίζουμε ότι κάποιες ιατρικές καταστάσεις, συνήθειες της καθημερινής μας ζωής αλλά και κληρονομικοί παράγοντες μπορούν να αυξήσουν τη πιθανότητα ανάπτυξης καρκίνου του παχέος εντέρου ή του ορθού.
Οι πιο κοινές επιβλαβείς καθημερινές μας συνήθειες περιλαμβάνουν μια δίαιτα πλούσια σε λίπη και επεξεργασμένα κρέατα, την παχυσαρκία, την περιορισμένη άσκηση, και το κάπνισμα.
Μερικοί άνθρωποι παρουσιάζουν υψηλότερο κίνδυνο ανάπτυξης καρκίνου του παχέος εντέρου, δεδομένου ότι έχουν κληρονομήσει ένα ελαττωματικό γονίδιο.
Οι άνθρωποι που έχουν έναν ή περισσότερα μέλη της οικογένειας τους με καρκίνο του παχέος εντέρου και του ορθού παρουσιάζουν υψηλότερο κίνδυνο να αναπτύξουν τον ίδιο καρκίνο. Μεγαλύτερο κίνδυνο διατρέχουν εκείνοι των οποίων έχει διαγνωστεί καρκίνος του παχέος εντέρου σε ένα στενό μέλος της οικογένειας τους (πρώτου βαθμού συγγένειας, όπως ένας γονέας, αδελφός ή αδελφή) κάτω από την ηλικία των 50 ετών, ή όταν υπάρχει καρκίνος παχέος εντέρου ή καρκίνου του ορθού σε περισσότερα μέλη από την ίδια πλευρά μιας οικογένειας (δηλαδή από την πλευρά της μητέρας ή του πατέρα).
Συμπτώματα καρκίνου του ορθού
Ο καρκίνος του ορθού (rectal cancer) συνήθως εκδηλώνεται με αίμα στα κόπρανα (κόκκινο ή σκούρο, συχνά αναμεμειγμένο με τα κόπρανα και βλέννη), αλλαγές στις κενώσεις που επιμένουν για εβδομάδες (νέα δυσκοιλιότητα ή διάρροια, εναλλαγές, επείγουσα τάση για κένωση/«βιασύνη», αίσθημα ατελούς κένωσης/τενεσμός), αλλαγή στο σχήμα/διάμετρο των κοπράνων («λεπτά» ή κορδονωτά), και κοιλιακό φούσκωμα/κράμπες.
Συχνές είναι και οι βλεννώδεις εκκρίσεις από το ορθό, ανεξήγητη κόπωση ή σιδηροπενική αναιμία (ζάλη, ωχρότητα, λαχάνιασμα στην κόπωση) λόγω χρόνιας απώλειας αίματος. Σε πιο προχωρημένες καταστάσεις μπορεί να εμφανιστούν απώλεια βάρους, επίμονος πόνος στον πρωκτό ή στη λεκάνη, συχνοουρία/δυσουρία ή αιματουρία όταν υπάρχει γειτνίαση με την ουροδόχο κύστη, ενώ σε σχεδόν αποφρακτικούς όγκους εμφανίζονται έντονο τυμπανισμό, εμέτοι, αδυναμία αποβολής αερίων/κοπράνων (επείγον).
Σημαντικό: οι αιμορροΐδες δεν αποκλείουν καρκίνο· επίμονο ορθοαιμορραγία >2–3 εβδομάδες, νέα αλλαγή στις κενώσεις μετά τα 45–50 έτη, οικογενειακό ιστορικό καρκίνου παχέος εντέρου/πολύποδων ή χρόνια φλεγμονώδης νόσος εντέρου απαιτούν άμεση εκτίμηση και κολονοσκόπηση. Αν παρουσιαστούν έντονος πόνος, συνεχής αιμορραγία, λιποθυμικό επεισόδιο, εμέτοι με αδυναμία κένωσης, αναζητήστε επείγουσα ιατρική βοήθεια.
Διάγνωση του καρκίνου του ορθού (rectal cancer)
Στην πράξη, η διάγνωση του καρκίνου του ορθού προχωρά βήμα-βήμα αλλά με απλά μέσα για τον ασθενή: ξεκινάμε με ιστορικό και μια σύντομη δακτυλική εξέταση ορθού που συχνά εντοπίζει τη βλάβη· ακολουθεί ενδοσκόπηση—συνήθως κολονοσκόπηση όλου του παχέος εντέρου με βιοψίες για να επιβεβαιώσουμε την ιστολογία και να δούμε αν υπάρχουν κι άλλες βλάβες. Σε χαμηλούς όγκους μπορεί να γίνει ορθοσκόπηση ώστε να μετρηθεί με ακρίβεια η απόσταση από την οδοντωτή γραμμή (βοηθά στον προεγχειρητικό σχεδιασμό).
Για τη σταδιοποίηση (πόσο βαθιά και προς τα πού έχει προχωρήσει), η βασική εξέταση είναι η μαγνητική πυέλου (MRI) που δείχνει τη σχέση του όγκου με τους σφιγκτήρες και τους γύρω ιστούς και αν «αγγίζει» κρίσιμες περιοχές· σε πολύ πρώιμες χαμηλές βλάβες χρησιμοποιούμε και διορθικό υπέρηχο (ERUS), που «βλέπει» λεπτομερώς τα στρώματα του τοιχώματος. Για να ελέγξουμε αν υπάρχει νόσος αλλού, κάνουμε αξονική θώρακος και κοιλίας (και ειδική αξονική ήπατος όταν χρειάζεται)· PET/CT ζητείται επιλεκτικά όταν θέλουμε να ξεκαθαρίσουμε αμφίβολα ευρήματα.
Στις εξετάσεις αίματος μετράμε έναν δείκτη που λέγεται CEA ως «σημείο εκκίνησης» για τη μελλοντική παρακολούθηση. Παράλληλα, σε όλους τους επιβεβαιωμένους αδενοκαρκίνους κάνουμε έλεγχο MMR/MSI (που, μεταξύ άλλων, ανιχνεύει πιθανά κληρονομικά σύνδρομα όπως το Lynch), ενώ αν υπάρχει μεταστατική νόσος ή σχεδιασμός για συστηματική θεραπεία, μπορεί να γίνει μοριακός έλεγχος (π.χ. RAS/BRAF/HER2) ώστε η ογκολογική ομάδα να επιλέξει πιο στοχευμένα φάρμακα—όλα αυτά αποφασίζονται εξατομικευμένα.
Αν προηγηθεί προεγχειρητική (νεοεπικουρική) θεραπεία με ακτινοθεραπεία/χημειοθεραπεία, επανεκτιμούμε με MRI και ενδοσκόπηση για να δούμε πόσο ανταποκρίθηκε ο όγκος· σε λίγες, προσεκτικά επιλεγμένες περιπτώσεις με πλήρη κλινική ανταπόκριση μπορεί να συζητηθεί πρωτόκολλο «watch & wait» (στενή οργανωμένη παρακολούθηση αντί άμεσης επέμβασης). Τέλος, όλα τα δεδομένα συζητούνται σε διεπιστημονικό συμβούλιο (MDT)—χειρουργός, ογκολόγος, ακτινοθεραπευτής, ακτινολόγος κ.ά.—ώστε να προκύψει προσωποποιημένο πλάνο (π.χ. τοπική εκτομή με TAMIS σε κατάλληλους T1 όγκους, σφιγκτηροσωστική επέμβαση ή APR όπου χρειάζεται).
Αν παρουσιαστούν επείγοντα σημάδια απόφραξης (έντονο φούσκωμα με εμέτους, αδυναμία αποβολής αερίων/κοπράνων, συνεχής αιμορραγία), απαιτείται άμεση νοσοκομειακή εκτίμηση.
(Υπάρχει επεξηγηση συντομογραφιών στο τέλος του άρθρου)
Θεραπεία του καρκίνου του ορθού (rectal cancer)
Ο στόχος μας είναι ριζική αφαίρεση του όγκου με καθαρά όρια (R0), διατηρώντας όπου είναι δυνατόν τους σφιγκτήρες και την ποιότητα ζωής. Η απόφαση λαμβάνεται πάντα σε διεπιστημονικό συμβούλιο (MDT – Multidisciplinary Team) με χειρουργό, ογκολόγο, ακτινοθεραπευτή, ακτινολόγο κ.ά., αφού μελετηθούν οι εξετάσεις (MRI – μαγνητική πυέλου, CT – αξονική, ενδοσκόπηση κ.λπ.).
1) Πρώιμη νόσος: όταν ο όγκος είναι μικρός και ρηχός
Σε καλά επιλεγμένους πρώιμους όγκους (π.χ. T1 χαμηλού κινδύνου) μπορεί να γίνει τοπική αφαίρεση από το ορθό:
- TAMIS (Transanal Minimally Invasive Surgery – διαπρωκτική ελάχιστα επεμβατική αφαίρεση),
- TEMS (Transanal Endoscopic Microsurgery – παρόμοια τεχνική με ενδοσκοπική υποβοήθηση),
- ή ESD (Endoscopic Submucosal Dissection – ενδοσκοπική αφαίρεση από τον υποβλεννογόνο*).
Αν η ιστολογική ανάλυση δείξει υψηλότερο ρίσκο, προτείνεται ριζικό χειρουργείο.
2) Το πρότυπο χειρουργείο όταν απαιτείται
Το κλασικό ογκολογικό χειρουργείο είναι η TME (Total Mesorectal Excision – ολική εκτομή μεσοορθού*). Γίνεται ανοικτά, λαπαροσκοπικά ή ρομποτικά.
- Όταν μπορούμε να κρατήσουμε τους σφιγκτήρες, μιλάμε για LAR (Low Anterior Resection – χαμηλή πρόσθια εκτομή*), συχνά με προστατευτική ειλεοστομία προσωρινά.
- Όταν ο όγκος είναι πολύ χαμηλά ή ο σφιγκτήρας δεν μπορεί να διατηρηθεί με ασφάλεια, απαιτείται APR (Abdominoperineal Resection – κοιλιοπερινεϊκή εκτομή με μόνιμη κολοστομία*).
3) Όταν ο όγκος είναι πιο προχωρημένος: πλήρης προεγχειρητική αγωγή
Στους τοπικά προχωρημένους όγκους προτιμάται η TNT (Total Neoadjuvant Therapy – συνολική προεγχειρητική θεραπεία*). Τι σημαίνει;
- Μπορεί να ξεκινά με ακτινοθεραπεία βραχείας διάρκειας (5 συνεδρίες, συχνά λέγεται «short-course») ή με μακρά χημειοακτινοθεραπεία (CRT – Chemoradiotherapy).
- Ακολουθεί χημειοθεραπεία πριν από το χειρουργείο (TME).
Η λογική είναι να «μαλακώσουμε» τον όγκο, να αυξήσουμε τις πιθανότητες πλήρους ανταπόκρισης και να μειώσουμε τον κίνδυνο μακρινών μεταστάσεων.
4) «Watch & Wait»: διατήρηση οργάνου χωρίς άμεσα χειρουργείο
Αν μετά την TNT ο όγκος δεν φαίνεται πλέον κλινικά (cCR – Clinical Complete Response), σε επιλεγμένους ασθενείς μπορούμε να συζητήσουμε πρωτόκολλο «Watch & Wait» (στενή παρακολούθηση χωρίς άμεση TME).
- Παρακολούθηση με ενδοσκόπηση, MRI και κλινική εξέταση ανά 3 μήνες τα πρώτα 2 χρόνια, μετά πιο αραιά.
- Αν υπάρξει τοπική επανεμφάνιση, συνήθως μπορούμε να «σώσουμε» την κατάσταση με χειρουργείο, χωρίς να χάνεται η συνολική επιβίωση.
5) Ειδικές βιοδείκτες και στοχευμένες θεραπείες
Σε όλους τους αδενοκαρκίνους ελέγχουμε MMR/MSI (Mismatch Repair / Microsatellite Instability).
- Αν ο όγκος είναι MSI-H ή dMMR (υψηλή μικροδορυφορική αστάθεια/διαταραχή επιδιόρθωσης), μπορεί να ωφεληθεί από ανοσοθεραπεία (π.χ. αναστολείς PD-1) σε συγκεκριμένα σενάρια.
Σε μεταστατική νόσο ή όταν σχεδιάζουμε φάρμακα-στόχο, μπορεί να γίνει μοριακός έλεγχος (RAS, BRAF, HER2) για να δούμε αν ταιριάζουν στοχευμένες θεραπείες (π.χ. anti-EGFR όταν RAS είναι «καθαρό»).
6) Τι σημαίνει πρακτικά για την ανάρρωση και την ποιότητα ζωής
Εφαρμόζουμε πρωτόκολλα ERAS (Enhanced Recovery After Surgery – ταχεία ανάρρωση μετά το χειρουργείο*): πρώιμη κινητοποίηση, πόνος υπό έλεγχο, γρήγορη σίτιση, λιγότερες επιπλοκές.
Μετά από πολύ χαμηλές αναστομώσεις μπορεί να εμφανιστεί LARS (Low Anterior Resection Syndrome): συχνές ή επείγουσες κενώσεις, μερική ακράτεια, «σπασμένες» κενώσεις. Αντιμετωπίζεται με διατροφή, φαρμακευτικές επιλογές και ασκήσεις πυελικού εδάφους/biofeedback.
7) Παρακολούθηση μετά τη θεραπεία
Χρειαζόμαστε οργανωμένο πρόγραμμα με:
- κλινικές επισκέψεις και CEA (Carcino-Embryonic Antigen – αιματολογικός δείκτης*),
- κολονοσκόπηση σε προκαθορισμένα διαστήματα,
- και απεικονίσεις (CT ή/και MRI) ανάλογα με το στάδιο και το ιστορικό.
Σε Watch & Wait το follow-up είναι πιο πυκνό (ιδίως τα πρώτα 2 χρόνια).
Τεχνικά σημεία Ενδιαφέροντος.
- Η επανένωση του εντέρου (αναστόμωση) γίνεται με σύγχρονους κυκλικούς αναστομωτήρες, μέσω των οποίων δημιουργείται ασφαλέστατη αναστόμωση, πράγμα που επιφέρει ελαχιστοποίηση των μετεγχειρητικών διαρροών (leaks). Η επανένωση είναι εφικτή εφ’ όσον ο όγκος ευρίσκεται υψηλότερα από τα 5 εκατοστά από τον δακτύλιο, λόγω του ότι χρειάζεται για καθαρά ογκολογικούς λόγους, ασφαλής απόσταση 2 εκατοστών περιφερικότερα του όγκου.
- Η επέμβαση γίνεται λαπαροσκοπικά ή ρομποτικά στο μεγαλύτερο μέρος αυτής, με στόχο την κινητοποίηση του παχέος εντέρου και παρασκευή των ιστών, με αποτέλεσμα την ελαχιστοποίηση της τομής, την μείωση του μετεγχειρητικού πόνου και την άμεση κινητοποίηση του ασθενούς.
- Στην περίπτωση όπου υπάρχει αδυναμία επιτέλεσης αναστόμωσης όταν ο όγκος είναι πολύ χαμηλά, ή υπάρχει διήθηση του σφιγκτηριακού μηχανισμού, τότε δυστυχώς απαιτείται η κοιλιοπερινεϊκή εκτομή του ορθού, δηλαδή η ολική συναφαίρεση ορθού, σφιγκτηριακού μηχανισμού και πρωκτού, και η δημιουργία μόνιμης τελικής κολοστομίας.
- Σε μερικές περιπτώσεις επίσης, πολύ χαμηλής αναστόμωσης ο χειρουργός μπορεί να επιλέξει και την παράλληλη δημιουργία προσωρινής “προφυλακτικής” ειλεοστομίας, για να εξασφαλιστεί η στεγανότητα της αναστόμωσης.
Μετχγχειρητική πορεία.
- Η μετεγχειρητική πορεία μετά από χειρουργείο ορθού οργανώνεται με πρωτόκολλα ERAS (ταχεία ανάρρωση): σηκώνεστε και περπατάτε από το ίδιο ή το επόμενο 24ωρο, η σίτιση ξεκινά νωρίς (διαυγή υγρά → μαλακή/κανονική τροφή), και ο πόνος ελέγχεται με συνδυασμό αναλγητικών ώστε να αποφευχθούν βαριά οπιοειδή.
- Συχνά υπάρχει προστατευτική ειλεοστομία· εκπαιδεύεστε από στοματοθεραπευτή για τη φροντίδα της και, εφόσον όλα εξελίσσονται ομαλά, σχεδιάζουμε αναστροφή (επανενωση του εντερου) συνήθως στις 6–12 εβδομάδες.
- Τις πρώτες εβδομάδες είναι αναμενόμενες αλλαγές στις κενώσεις (συχνότερες, επείγουσες, «σπασμένες»): αυτό λέγεται LARS (Low Anterior Resection Syndrome) και βελτιώνεται με διατροφικές προσαρμογές, υγρά/φυτικές ίνες με μέτρο, αποφυγή ερεθιστικών τροφών, φάρμακα όπου χρειάζεται και ασκήσεις πυελικού εδάφους/biofeedback.
- Οι ουλές παρακολουθούνται για ερυθρότητα/έκκριση· φοράτε αντιθρομβωτικές κάλτσες και λαμβάνετε προφύλαξη θρόμβωσης όπως έχει δοθεί.
- Επιστροφή σε περπάτημα καθημερινά από νωρίς, σε ελαφριές δουλειές ~2 εβδομάδες (εξαρτάται από την επέμβαση), αποφυγή άρσης βάρους >5–7 κιλά για 4–6 εβδομάδες και οδήγηση μόλις ο πόνος/φάρμακα το επιτρέψουν.
- Το παθολογοανατομικό αποτέλεσμα (όρια, λεμφαδένες) καθορίζει αν θα χρειαστεί συμπληρωματική αγωγή· προγραμματίζονται τα πρώτα ραντεβού παρακολούθησης με κλινική εξέταση, δείκτη CEA και, όταν απαιτείται, απεικονίσεις.
- Αναζητήστε άμεσα ιατρική βοήθεια σε επίμονο πυρετό, έντονο πόνο που δεν υφίεται, προοδευτικό φούσκωμα με εμέτους, αιμορραγία, ερυθρότητα/πύον από την τομή ή απότομη μείωση ούρων.
TAMIS (Transanal Minimally Invasive Surgery – διαπρωκτική ελάχιστα επεμβατική αφαίρεση)
Είναι τεχνική που μας επιτρέπει να αφαιρέσουμε πρώιμους, επιλεγμένους όγκους του ορθού από το εσωτερικό, μέσω του πρωκτού, χωρίς τομές στην κοιλιά. Με ειδικό διαπρωκτικό «τροκάρ» και λαπαροσκοπικά εργαλεία γίνεται ολόπαχη εκτομή της βλάβης με ασφαλή όρια (συνήθως ~1 εκ.), και το παρασκεύασμα αποστέλλεται για οριστική ιστολογική ανάλυση. Η TAMIS προτιμάται σε T1 χαμηλού κινδύνου (μικροί όγκοι, καλά διαφοροποιημένοι, χωρίς λεμφαγγειακή/αγγειακή διήθηση), συνήθως έως ~3 εκ. και σε απόσταση έως ~8–10 εκ. από τον πρωκτό· T2 ή “υψηλού κινδύνου” T1 αντιμετωπίζονται κατ’ αρχήν με ριζική εκτομή (TME). Πλεονεκτήματα: μικρότερος πόνος, βραχεία νοσηλεία/μερικές φορές αυθημερόν, ταχεία επιστροφή στις δραστηριότητες, διατήρηση σφιγκτήρων. Πιθανοί κίνδυνοι: αιμορραγία, διάτρηση/επικοινωνία με περιτόναιο που σπάνια απαιτεί λαπαροσκοπική αντιμετώπιση, λοίμωξη, παροδική ενόχληση στις κενώσεις (μακροπρόθεσμα συνήθως χωρίς επίπτωση στην εγκράτεια). Αν η ιστολογία δείξει υψηλού κινδύνου χαρακτηριστικά (κακή διαφοροποίηση, θετικά όρια, λεμφαγγειακή/περινευρική διήθηση, βαθιά διήθηση), τότε συστήνεται συμπληρωματική ριζική εκτομή (TME) ή/και ογκολογική θεραπεία, μετά από διεπιστημονική συζήτηση (MDT). Η παρακολούθηση περιλαμβάνει τακτική ορθοσκόπηση/κολονοσκόπηση και, όπου χρειάζεται, MRI πυέλου.
TEMS (Transanal Endoscopic Microsurgery)
Είναι εξειδικευμένη διαπρωκτική τεχνική αφαίρεσης βλαβών του ορθού με χρήση άκαμπτου ορθοσκοπίου και μικροχειρουργικών εργαλείων υπό μεγέθυνση. Επιτρέπει ακριβή, ολόπαχη εκτομή με ασφαλή όρια σε πρώιμους, επιλεγμένους όγκους (κυρίως T1 χαμηλού κινδύνου) ή μεγάλους πολύποδες που δεν αφαιρούνται ενδοσκοπικά, συνήθως σε απόσταση έως ~8–12 εκ. από την οδοντωτή γραμμή. Πλεονεκτήματα: υψηλή ακρίβεια εκτομής, καλή αιμόσταση, διατήρηση σφιγκτήρων, λιγότερος πόνος και σύντομη νοσηλεία. Κίνδυνοι (σπάνιοι): αιμορραγία, διάτρηση/περιτοναιοποίηση που μπορεί να απαιτήσει λαπαροσκοπική αντιμετώπιση, λοίμωξη, παροδικές διαταραχές κένωσης χωρίς μόνιμη επίπτωση στην εγκράτεια. Αν η οριστική ιστολογία δείξει υψηλό κίνδυνο (θετικά όρια, κακή διαφοροποίηση, λεμφαγγειακή/περινευρική διήθηση ή βάθος >T1), συστήνεται συμπληρωματική ριζική εκτομή (TME) και συζήτηση σε MDT (διεπιστημονικό συμβούλιο). Η παρακολούθηση γίνεται με τακτική ορθοσκόπηση/κολονοσκόπηση και, όπου ενδείκνυται, MRI πυέλου. (Σημ.: TEMS και TAMIS έχουν παρόμοια φιλοσοφία· η πρώτη χρησιμοποιεί άκαμπτο σύστημα με μικροσκόπηση, η δεύτερη εύκαμπτο «port» με λαπαροσκοπικά εργαλεία.)
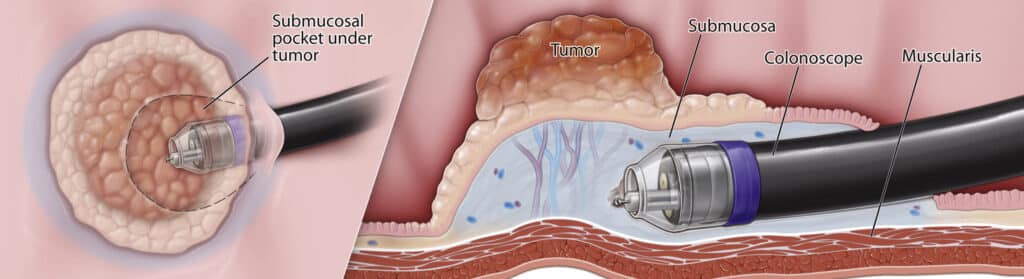
ESD (Endoscopic Submucosal Dissection – ενδοσκοπική υποβλεννογόνια εκτομή)
Είναι προχωρημένη ενδοσκοπική τεχνική (από εξειδικευμένο επεμβατικό γαστρεντερολόγο) που επιτρέπει ενιαία (en bloc) αφαίρεση μεγάλων επιπέδων/επίπεδων-υπεγερμένων πολυπόδων και πρώιμων, επιφανειακών καρκινωμάτων του ορθού που περιορίζονται στον βλεννογόνο ή στον υποβλεννογόνιο χωρίς ύποπτη λεμφαδενική νόσο. Με ειδική έγχυση δημιουργείται «μαξιλαράκι» κάτω από τη βλάβη, γίνεται ακριβής διατομή του υποβλεννογόνιου και αφαιρείται ολόκληρο το παρασκεύασμα για οριστική ιστολογική εκτίμηση (R0/κάθετα-πλάγια όρια, βάθος διήθησης, λεμφαγγειακή/περινευρική διήθηση). Πλεονεκτήματα: διατήρηση οργάνου/σφιγκτήρων, χαμηλότερη ανάγκη για χειρουργείο σε κατάλληλες βλάβες, και καλύτερη παθολογοανατομική σταδιοποίηση έναντι της EMR (πολλαπλών «κομματιών»). Όρια/ενδείξεις: προτιμάται σε μη διηθητικές ή πολύ πρώιμες διηθητικές βλάβες (π.χ. T1 sm1 χαμηλού κινδύνου) χωρίς ενδείξεις διηθητικότητας στην απεικόνιση/ενδοσκοπική εκτίμηση· αν η ιστολογία δείξει υψηλό κίνδυνο (θετικά όρια, βαθιά υποβλεννογόνια διήθηση, κακή διαφοροποίηση, λεμφαγγειακή/περινευρική διήθηση), συστήνεται συμπληρωματική ριζική εκτομή (TME) μετά από MDT. Επιπλοκές: αιμορραγία (συνήθως ελέγξιμη ενδοσκοπικά), διάτρηση (σπάνια, αλλά απαιτεί άμεση αντιμετώπιση/χειρουργική εφεδρεία), σπάνια στένωση. Η παρακολούθηση γίνεται με προγραμματισμένη ορθοσκόπηση/κολονοσκόπηση για έγκαιρη ανίχνευση υποτροπής/υπολειπόμενου ιστού.
| Συντομογραφία | Όρος (EN) | Επεξήγηση στα ελληνικά |
|---|---|---|
| MRI | Magnetic Resonance Imaging | Μαγνητική τομογραφία πυέλου για ακριβή σταδιοποίηση όγκων ορθού. |
| ERUS | Endorectal Ultrasound | Διορθικός υπέρηχος για εκτίμηση βάθους διήθησης (T-στάδιο). |
| CT | Computed Tomography | Αξονική θώρακος/κοιλίας για έλεγχο απομακρυσμένων μεταστάσεων. |
| PET/CT | Positron Emission Tomography / CT | Τομογραφία εκπομπής ποζιτρονίων με CT· επιλεκτικά για αμφίβολα ευρήματα. |
| CEA | Carcinoembryonic Antigen | Αιματολογικός δείκτης για παρακολούθηση. |
| MMR | Mismatch Repair | Διαταραχή σχετίζεται με MSI & σύνδρομο Lynch. |
| MSI | Microsatellite Instability | Βιοδείκτης πρόγνωσης/θεραπείας & ελέγχου για Lynch. |
| RAS | KRAS / NRAS status | Καθορίζει καταλληλότητα για anti-EGFR θεραπείες. |
| BRAF | BRAF status | Μετάλλαξη με προγνωστική/προβλεπτική αξία. |
| HER2 | Human Epidermal Growth Factor Receptor 2 | Υπερέκφραση/ενίσχυση που στοχεύεται σε επιλεγμένες περιπτώσεις. |
| CRM | Circumferential Resection Margin | Κυκλοτερή χειρουργικά όρια· κρίσιμα για R0 εκτομή. |
| EMVI | Extramural Vascular Invasion | Εξωτοιχωματική αγγειακή διήθηση· δείκτης υψηλού κινδύνου υποτροπής. |
| TME | Total Mesorectal Excision | Ολική εκτομή μεσοορθού· πρότυπο χειρουργείο. |
| TaTME | Transanal Total Mesorectal Excision | Διαπρωκτική προσέγγιση «από κάτω προς τα πάνω» σε επιλεγμένες περιπτώσεις. |
| TAMIS | Transanal Minimally Invasive Surgery | Τοπική εκτομή για πρώιμους όγκους (π.χ. T1). |
| LAR | Low Anterior Resection | Χαμηλή πρόσθια εκτομή· συχνά με προστατευτική ειλεοστομία. |
| APR | Abdominoperineal Resection | Κοιλιοπερινεϊκή εκτομή με μόνιμη κολοστομία όταν δεν διατηρούνται σφιγκτήρες. |
| MDT | Multidisciplinary Team | Διεπιστημονικό συμβούλιο (χειρουργός, ογκολόγος, ακτινοθεραπευτής, ακτινολόγος κ.ά.). |
| CRT | Chemoradiotherapy | Χημειοακτινοθεραπεία (πριν/μετά το χειρουργείο). |
| neo-CRT | Neoadjuvant Chemoradiotherapy | Προεγχειρητική θεραπεία για συρρίκνωση όγκου/βελτίωση CRM. |
| cCR | Clinical Complete Response | Κλινική πλήρης ανταπόκριση (πιθανό “watch & wait”). |
| R0 | R0 Resection | Εκτομή με καθαρά όρια, χωρίς υπόλειμμα. |
| QoL | Quality of Life | Ποιότητα ζωής (εντερική/ουρολογική/σεξουαλική λειτουργία). |
| LARS | Low Anterior Resection Syndrome | Σύνδρομο μετά LAR: συχνές/επειγούσες κενώσεις, ακράτεια, κατακερματισμός. |
FAQ – Συχνές Ερωτήσεις
1. Ποια είναι τα συνήθη συμπτώματα του καρκίνου του ορθού;
Τα πιο συχνά συμπτώματα είναι αίμα στα κόπρανα, αλλαγές στις κενώσεις (διάρροια, δυσκοιλιότητα ή εναλλαγές), αίσθημα ατελούς κένωσης και πόνος ή βάρος χαμηλά στην κοιλιά ή στον πρωκτό. Μπορεί επίσης να εμφανιστεί ανεξήγητη κόπωση, αναιμία ή απώλεια βάρους. Σε κάθε επίμονο σύμπτωμα από το ορθό χρειάζεται άμεση εκτίμηση από εξειδικευμένο χειρουργό.
2. Πώς γίνεται η διάγνωση και η σταδιοποίηση του καρκίνου του ορθού;
Η διάγνωση ξεκινά με κλινική εξέταση και δακτυλική εξέταση ορθού και επιβεβαιώνεται με κολονοσκόπηση και βιοψία. Η σταδιοποίηση περιλαμβάνει μαγνητική τομογραφία πυέλου, αξονική θώρακος–κοιλίας και εξειδικευμένες εξετάσεις αίματος, ώστε να εκτιμηθεί το βάθος διήθησης, οι λεμφαδένες και τυχόν μεταστάσεις. Η σωστή σταδιοποίηση είναι απαραίτητη για τον σχεδιασμό της βέλτιστης θεραπείας.
3. Ποιες είναι οι σύγχρονες θεραπευτικές επιλογές για τον καρκίνο του ορθού;
Η θεραπεία είναι εξατομικευμένη και συχνά συνδυάζει χειρουργείο, χημειοθεραπεία και ακτινοθεραπεία. Σε πρώιμα στάδια μπορεί να γίνει τοπική ενδοσκοπική ή διαπρωκτική εκτομή, ενώ σε πιο προχωρημένα εφαρμόζεται ολική μεσοορθική εκτομή με λαπαροσκοπική ή ρομποτική τεχνική. Προεγχειρητική χημειο-ακτινοθεραπεία μειώνει τον όγκο και βελτιώνει τα ογκολογικά αποτελέσματα, συχνά με στόχο τη διατήρηση των σφιγκτήρων.
4. Θα χρειαστεί να κάνω προσωρινή ή μόνιμη παραφυσιώδη στομία;
Η ανάγκη για στομία εξαρτάται από το στάδιο, τη θέση του όγκου σε σχέση με τον σφιγκτηριακό μηχανισμό και τον τύπο της επέμβασης. Σε χαμηλούς όγκους μπορεί να απαιτηθεί προσωρινή προστατευτική ειλεοστομία για λόγους ασφάλειας της αναστόμωσης, η οποία συνήθως κλείνει μετά από λίγους μήνες. Μόνιμη στομία χρειάζεται μόνο σε επιλεγμένες περιπτώσεις όπου δεν είναι εφικτή η διατήρηση των σφιγκτήρων χωρίς να θυσιαστεί η ογκολογική ασφάλεια.
5. Πώς γίνεται η παρακολούθηση μετά τη θεραπεία του καρκίνου του ορθού;
Μετά την ολοκλήρωση της θεραπείας, ο ασθενής παρακολουθείται με τακτικές κλινικές εξετάσεις, αιματολογικούς ελέγχους (π.χ. CEA), ενδοσκοπήσεις και απεικονιστικές εξετάσεις σύμφωνα με διεθνή πρωτόκολλα. Η στενή παρακολούθηση επιτρέπει την έγκαιρη ανίχνευση τυχόν υποτροπής ή νέων βλαβών στο παχύ έντερο. Παράλληλα, αξιολογούνται και αντιμετωπίζονται τυχόν λειτουργικές διαταραχές, ώστε να διασφαλίζεται η καλύτερη δυνατή ποιότητα ζωής.
Τελευταία ιατρική επιμέλεια: 10/12/2025 από τον Δρ. Γεώργιος Σάμπαλης, MD, PhD

